Ecuación de velocidad
En el punto anterior hemos definido la velocidad instantánea como un límite de un cociente entre la variación de la concentración de los reactivos en un tiempo determinado cuando este tiempo tiende a cero. Es fácil ver (con conocimientos básicos de matemáticas) que esta relación es justamente la derivada de la concentración respecto del tiempo:
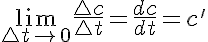
Si recuerdas la interpretación geométrica de la derivada sabrás que la pendiente de la recta tangente a la curva en un punto es igual a la derivada de la función en ese punto.
Supongamos que estudiamos la reacción de formación del amoníaco:
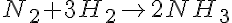
Si nos fijamos en la variación en la concentración de uno de los reactivos (el nitrógeno), podemos escribir la expresión de la velocidad instantánea del siguiente modo:
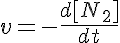
El signo negativo significa que el reactivo está desapareciendo.
Pero esta misma velocidad la podemos escribir en función del resto de sustancias intervinientes en la reacción. Si tenemos en cuenta que por cada molécula de nitrógeno desaparecen 3 de hidrógeno, también será cierto que la velocidad de desaparición del hidrógeno es tres veces superior a la del nitrógeno, por tanto:
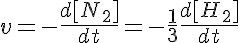
Y por la misma razón, también podemos escribir la ecuación anterior en función de las variaciones de concentración de los productos:
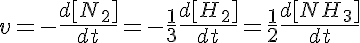
En el laboratorio, la velocidad de una reacción se calcula midiendo la concentración de alguna de las sustancias intervinientes en diferentes tiempos. Una vez llevados los valores a una gráfica, podemos calcular la pendiente de la tangente en diferentes puntos para conocer la velocidad instantánea en cada momento.
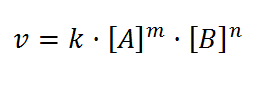 De todas las variables que afectan a la velocidad de reacción, normalmente se suele hacer más hincapié en las concentraciones de las sustancias que toman parte en la reacción. Si se mantienen constantes variables como la temperatura, la presión y otras, entonces se puede determinar experimentalmente que la velocidad de una reacción es una función simple de dichas concentraciones. Experimentalmente, se puede comprobar que, en la mayoría de los casos, la velocidad es directamente proporcional al producto de determinadas potencias enteras de las concentraciones:v=k
De todas las variables que afectan a la velocidad de reacción, normalmente se suele hacer más hincapié en las concentraciones de las sustancias que toman parte en la reacción. Si se mantienen constantes variables como la temperatura, la presión y otras, entonces se puede determinar experimentalmente que la velocidad de una reacción es una función simple de dichas concentraciones. Experimentalmente, se puede comprobar que, en la mayoría de los casos, la velocidad es directamente proporcional al producto de determinadas potencias enteras de las concentraciones:v=k
⋅]
donde
β
γ
β
Los órdenes parciales que respectan de las concentraciones de los reactivos tienen coincidencia con los coeficientes estequiométricos de las diferentes ecuaciones químicas. Sin embargo, se debe indicar que en un inicio no hay relación entre ellos.
La expresión para la ecuación de velocidad es:
Velocidad = K [A]^n[B]^m
De donde n y m se consiguen de manera experimental, y hacen referencia al orden parcial de la reacción del reactivo A y el reactivo B, siendo la suma de n y m la que determine el orden total de dicha reacción.
A la constante de proporcionalidad se le designa la letra K, y se la conoce como constante de velocidad. Esta suele ser la velocidad de la reacción cuando las concentraciones de los reactivos en su totalidad son la unidad, es decir, 1 mol/l.

La K, es específica para cada reacción, y es dependiente de la temperatura. Las unidades en las que se expresa K, están determinadas por el orden de la reacción en total, y se deben adaptar a las condiciones en las que la velocidad se exprese.
Para la determinación de la ecuación de velocidad en una reacción química, se debe investigar la dependencia que tiene la velocidad con respecto a la concentración de los reactivos que participan en la reacción, por lo que es necesario saber los órdenes parciales, y el valor de la constante de velocidad.
Una manera fácil de hallar la ecuación de velocidad es usar el método de la velocidad inicial, en el cual se determina la velocidad de la reacción al inicio de ésta. En el momento inicial de la reacción, las concentraciones de los reactivos se encuentra aún elevadas, y la velocidad instantánea es sencilla de medir con gran precisión. Esto consiste en variar la concentración de uno de los reactivos, manteniendo las concentraciones de los demás reactivos constantes, y así poder estudiar como varía o se modifica la velocidad.

No hay comentarios.:
Publicar un comentario